初中化学是基础科学教育中的重要部分,为学生们提供了关于物质性质、化学反应以及实验操作的基础知识。本文将详细总结初中化学的核心知识点,帮助学生更好地理解和掌握这些内容。
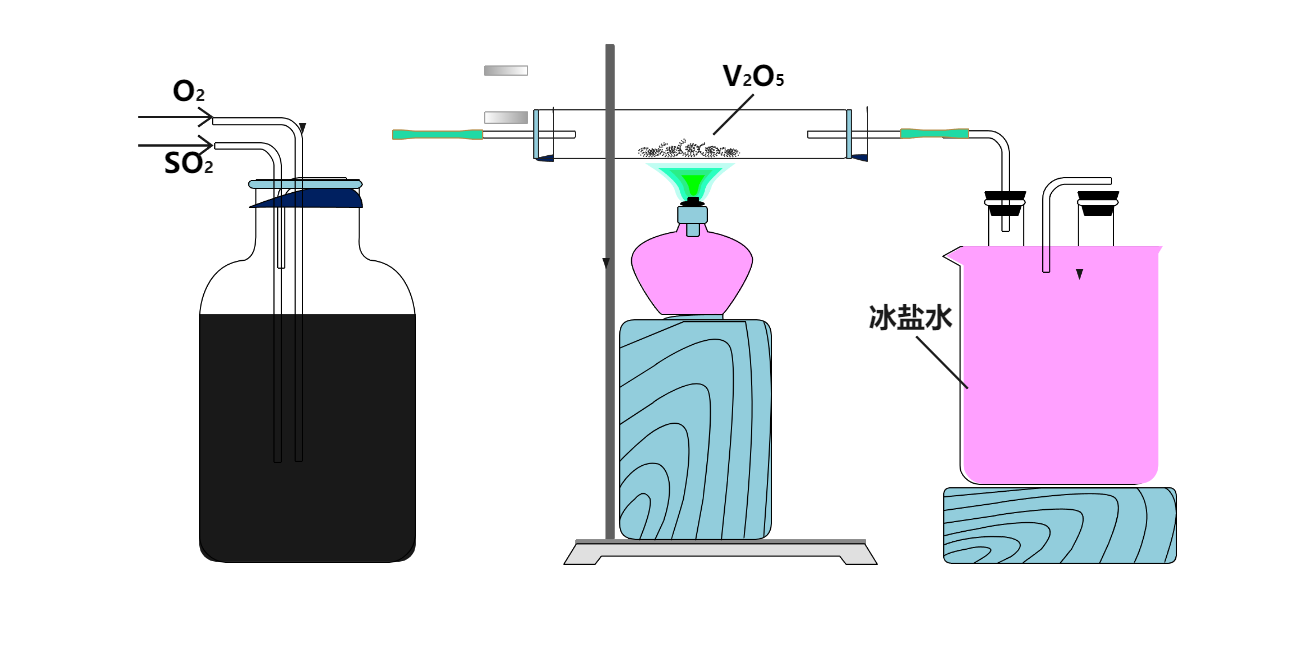
通用化学实验示意图 | 点击此处直接使用
——
一、物质的基本性质
1. 物质的定义和分类
物质是具有质量和体积的实体。根据其状态和组成,物质可以分为以下几类:
- 固体:固体具有固定的形状和体积,分子或原子排列整齐,如冰、盐。固体的性质包括硬度、密度等。
- 液体:液体没有固定形状,但有固定体积,分子或原子排列较为自由,如水、酒精。液体的性质包括流动性、粘度等。
- 气体:气体既没有固定形状也没有固定体积,分子或原子之间距离较远,如空气、氮气。气体的性质包括压强、体积、温度等。
2. 物质的性质
物质的性质包括物理性质和化学性质:
- 物理性质:描述物质在不改变其化学组成的情况下的表现。
- 化学性质:描述物质在化学反应中表现出的特性。
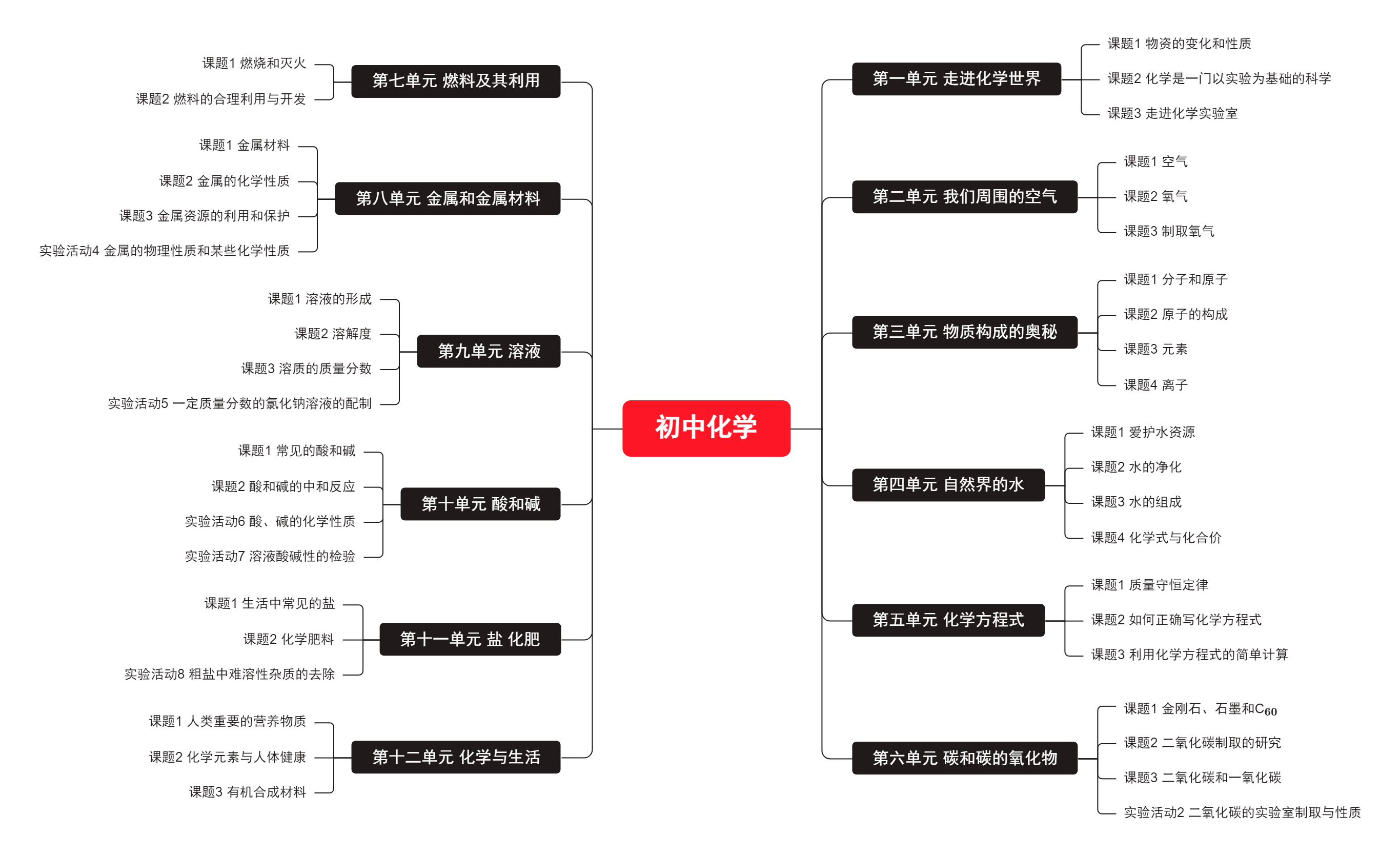
初中化学课本 | 点击此处直接使用
——
二、化学元素与化合物
1. 化学元素
化学元素是由相同种类的原子构成的物质,每种元素都有其独特的化学符号。例如:
- 氢(H):最轻的元素,常以分子形式存在(H₂)。
- 氧(O):支持燃烧的元素,存在于空气中。
- 碳(C):构成有机化合物的基础元素,存在于石油、天然气中。
元素在周期表中按原子序数排列,周期表中的元素分为金属、非金属和半金属。金属通常具有良好的导电性和导热性;非金属如氮、氧则常以气体形式存在;半金属如硅则具有介于金属和非金属之间的性质。

化学元素周期表 | 点击此处直接使用
2. 化合物
化合物是由不同元素的原子按一定比例结合而成的物质。化合物的性质与其组成元素的性质可能有所不同。例如:
- 水(H₂O):由氢和氧结合而成,具有良好的溶解能力和高比热容。
- 二氧化碳(CO₂):由一个碳原子和两个氧原子组成,是温室气体之一,对全球变暖有影响。
化合物可以通过化学反应进行分解或合成。例如,水可以通过电解反应分解为氢气和氧气,二氧化碳可以通过植物光合作用转化为氧气。
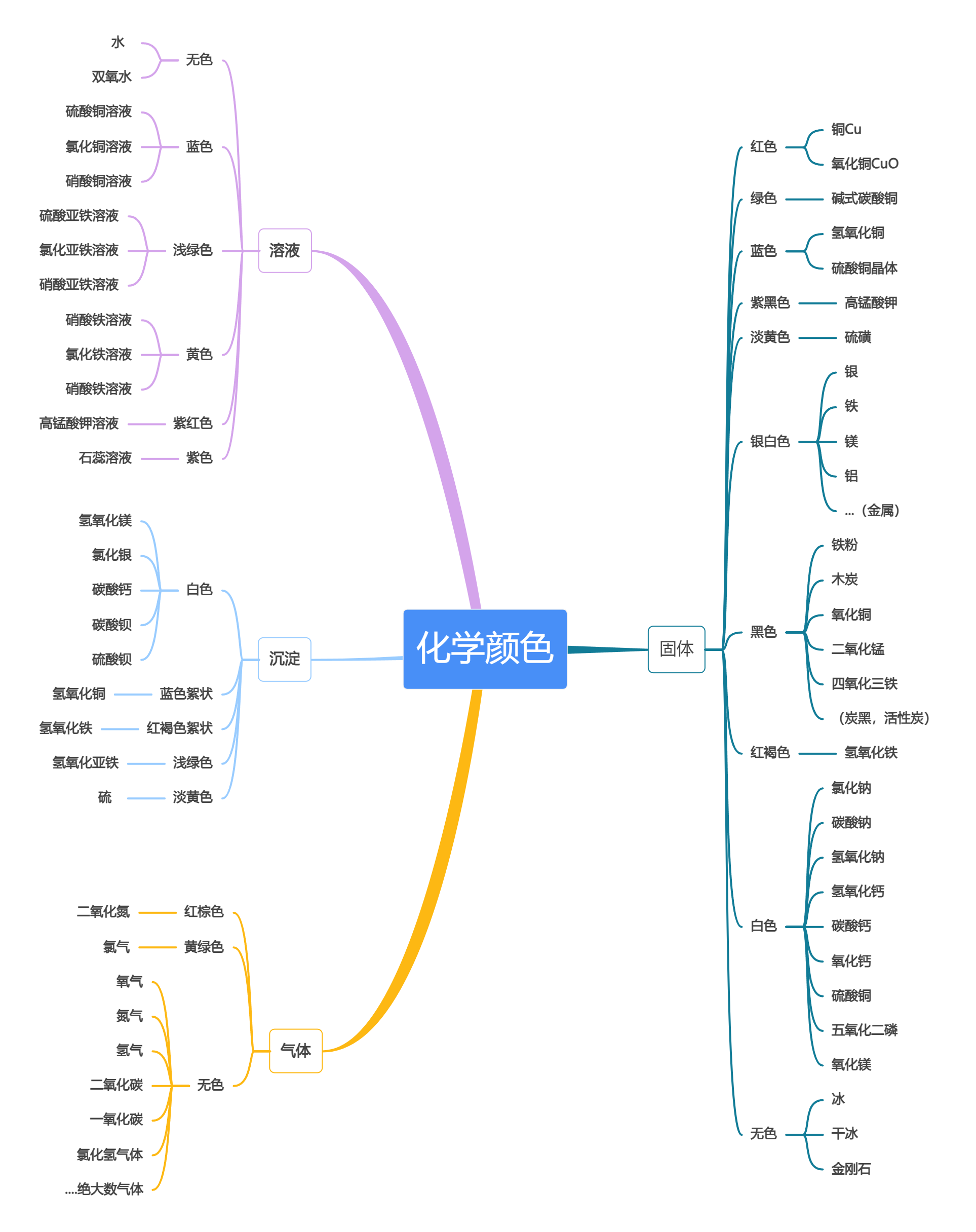
化学颜色 | 点击此处直接使用
——
三、原子和分子
1. 原子
原子是化学元素的基本单位,由原子核和围绕其旋转的电子组成。原子核由质子和中子构成,质子带正电,中子不带电。电子带负电,围绕原子核旋转,形成电子层。原子的质量主要集中在原子核中,而原子的体积主要由电子层决定。原子的排列和数量决定了物质的性质和行为。
2. 分子
分子是由两个或更多原子通过化学键结合而成的粒子。分子的结构决定了物质的性质。例如:
- 水分子(H₂O):由两个氢原子和一个氧原子组成,呈V形结构,具有极性的特性。
- 二氧化碳分子(CO₂):由一个碳原子和两个氧原子组成,线性结构,能吸收红外辐射。
分子的结构不仅影响其化学性质,还影响物质的物理性质,例如熔点、沸点和溶解度等。
——
四、化学反应及其类型
1. 化学反应的基本概念
化学反应是指物质之间发生变化,生成新物质的过程。化学反应符合质量守恒定律,即反应前后原子的总数不变。反应物通过化学反应生成新的产物。
化学反应通常需要一定的条件,如温度、压力和催化剂等。通过观察反应的现象和产物,可以研究反应的特性和机制。
2. 常见的化学反应类型
- 合成反应:两个或更多物质反应生成一个新物质。反应方程式:2H₂ + O₂ → 2H₂O例子:氢气与氧气反应生成水。
- 分解反应:一个物质分解成两个或更多物质。反应方程式:2H₂O → 2H₂ + O₂例子:水分解为氢气和氧气。
- 置换反应:一个元素取代化合物中的另一个元素。反应方程式:Zn + 2HCl → ZnCl₂ + H₂例子:锌与盐酸反应生成氯化锌和氢气。
- 双重置换反应:两个化合物中的元素互换位置。反应方程式:AgNO₃ + NaCl → AgCl + NaNO₃例子:硝酸银与氯化钠反应生成氯化银和硝酸钠。

金属元素基础化学方程式 | 点击此处直接使用
3. 化学反应速率
化学反应速率是指反应进行的快慢。影响反应速率的因素包括:
- 温度:提高温度通常会加快反应速率,因为分子运动加快,碰撞频率增加,从而加快反应速率。
- 浓度:提高反应物的浓度可以增加反应速率,因为更多的反应物分子增加了碰撞的机会。
- 催化剂:催化剂是加快反应速率而自身不被消耗的物质。例如,酶在生物反应中作为催化剂,加速反应过程。
- 表面积:增加反应物的表面积(如将固体粉碎)能提高反应速率,因为更大表面积的物质与其他物质接触的机会增多。

基础化学 | 点击此处直接使用
——
五、化学实验及其方法
1. 酸碱中和反应
酸碱中和反应是酸与碱反应生成盐和水的过程,常用于测定酸碱浓度。
- 反应方程式:HCl + NaOH → NaCl + H₂O
- 实验操作:使用酸碱指示剂(如石蕊试纸)检测反应的终点。当指示剂变色时,说明酸碱反应已完成,可以使用滴定法定量测定酸碱浓度。
2. 氧气的制备和检验
氧气的制备通常通过分解过氧化氢进行:
- 反应方程式:2H₂O₂ → 2H₂O + O₂
- 实验操作:在实验中,将过氧化氢与催化剂(如二氧化锰)混合,加热可加快反应生成氧气。用点燃的木条检验氧气,木条在氧气中会重新燃烧,证明了氧气的存在。
3. 氢气的制备和检验
氢气的制备通常通过酸与金属反应进行:
- 反应方程式:Zn + 2HCl → ZnCl₂ + H₂
- 实验操作:将锌片加入盐酸中,可以观察到氢气的产生。氢气的检验可以通过用点燃的木条接触氢气,氢气燃烧时会发出“嘭”的一声爆炸声,证明氢气的存在。
4. 盐的结晶
盐的结晶通常通过蒸发溶液中的水分来获得盐晶体:
- 实验步骤:将溶解在水中的盐水加热,蒸发水分,直至盐晶体析出。通过观察盐晶体的形状和结构,可以了解盐的结晶过程和性质。
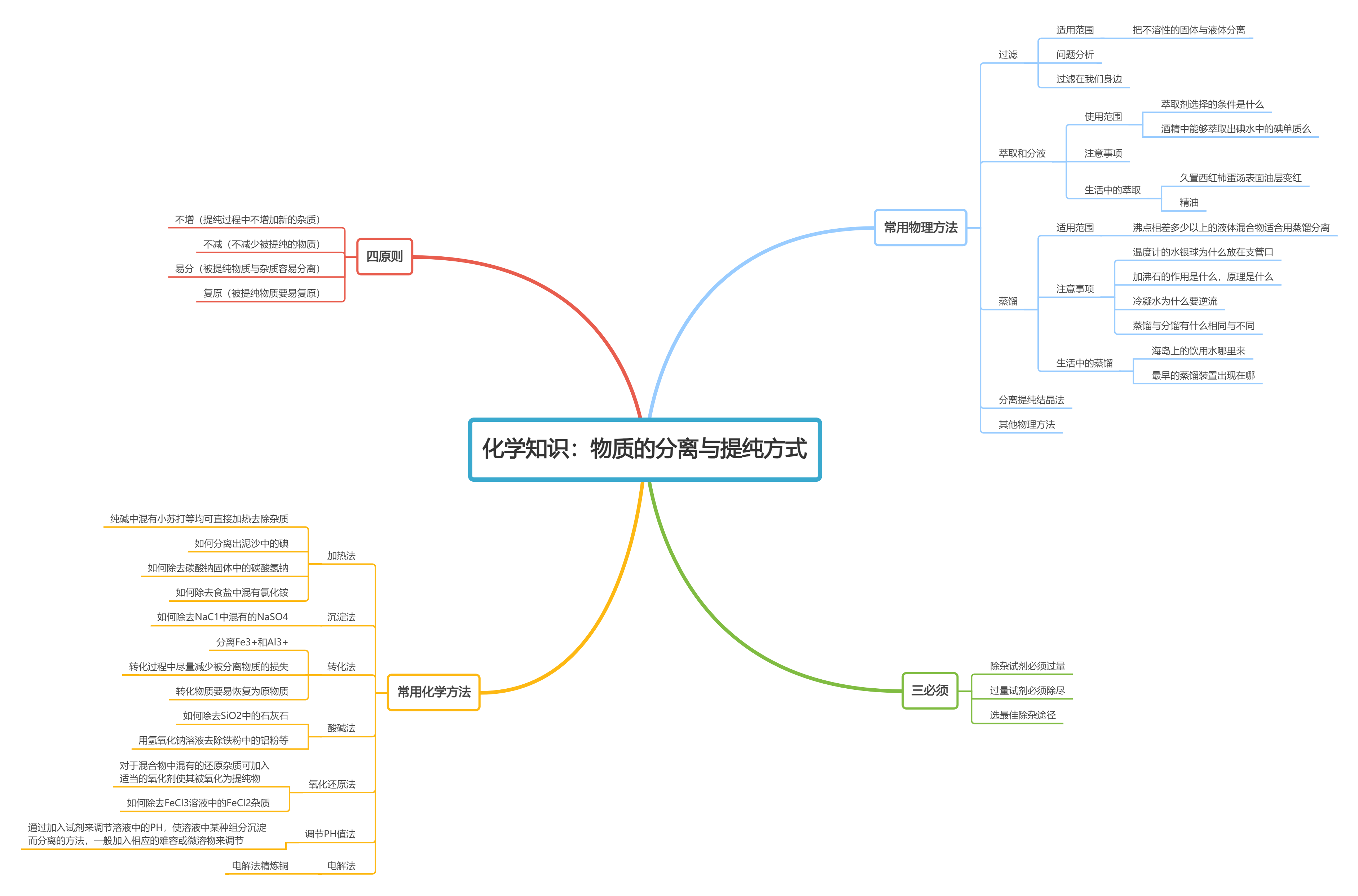
化学知识:物质的分离与提纯方式 | 点击此处直接使用
——
六、学习初中化学的策略与技巧
- 理解概念:使用模型、实验观察和做笔记来加深理解。
- 熟练掌握化学方程式:通过大量练习和掌握配平技巧。
- 进行实验操作:遵守安全规范、记录数据。
- 解决问题:理清思路、运用公式和查找资料。
- 巩固知识:定期复习、做练习题和参与讨论。
- 利用学习资源:充分利用教材、在线教育资源和学习工具。
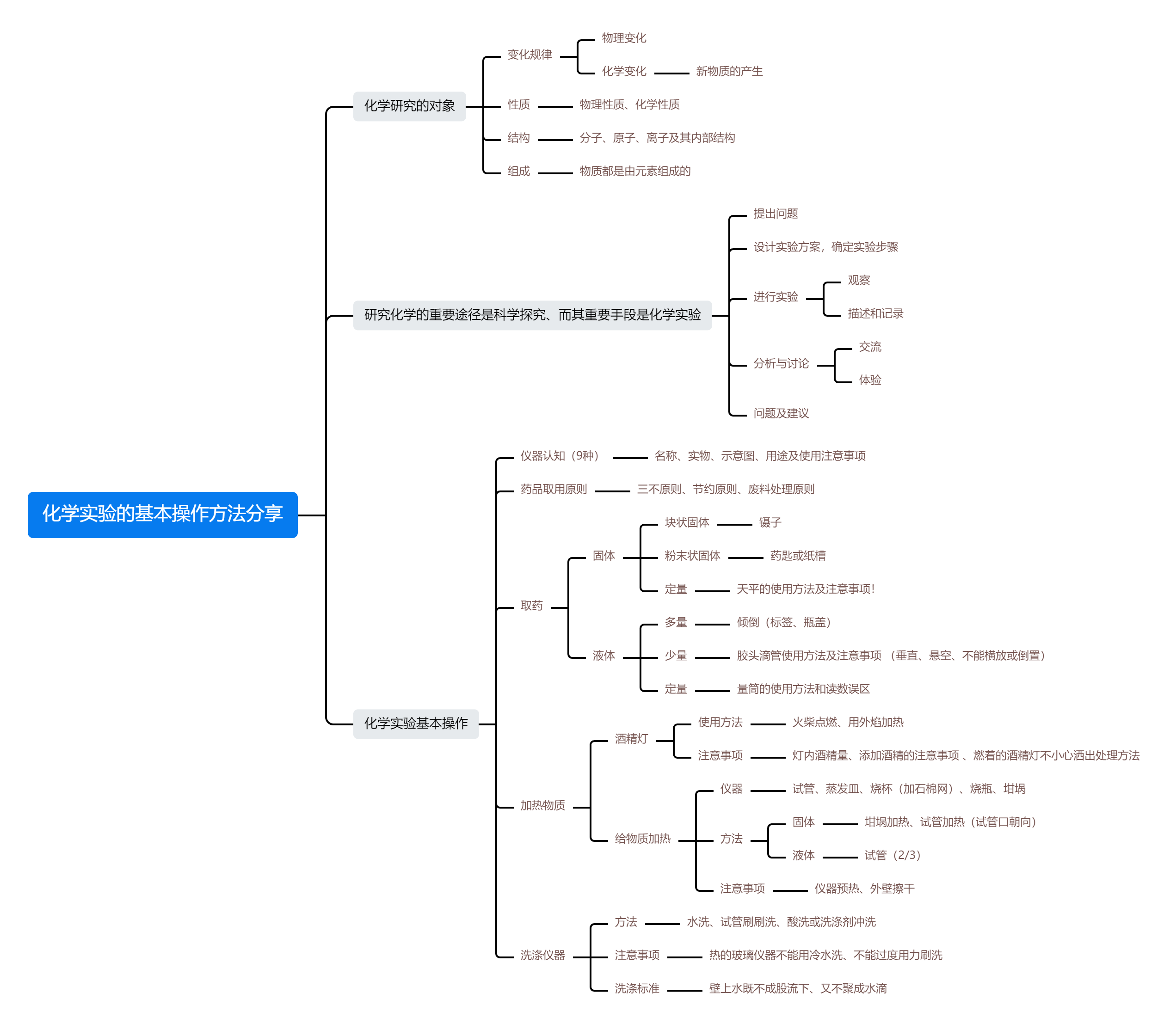
化学实验的基本操作方法 | 点击此处直接使用
——
七、结语
学习初中化学不仅能为高中化学学习打下基础,还能提高科学素养和解决实际问题的能力。通过系统学习和掌握核心知识点,学生可以更好地理解化学现象和反应,提升科学思维能力。
——
ProcessOn作为一款专业强大的绘图工具,支持在线编辑流程图、思维导图、甘特图、原型图、UML、网络拓扑图等多种图形。使用者可以从零开始创建新内容,也可以轻松地在现有作图框架、案例模板上进行编辑和修改,操作简单易上手。







